Certains climatologues estiment, sur la base de modèles informatiques, que l’augmentation de la teneur en CO2 dans l’atmosphère pourrait avoir une influence sur le climat. Avant d’aborder ce problème il est important d’analyser le comportement de ce gaz dans les basses couches atmosphériques.
A cette fin envisageons une boîte opaque contenant, à l’abri de tout rayonnement extérieur, une certaine quantité d’air sec à 15°C et à la pression d’une atmosphère. Dans cette boîte 78 % des molécules sont des molécules d’azote N2 et 21 % sont des molécules d’oxygène O2. Le troisième constituant par ordre d’abondance est l’argon Ar (environ 1 % des molécules). Les molécules de CO2 n’interviennent que pour environ 0,04 %. Toutes ces molécules n’ont pratiquement pas d’interaction entre elles, si ce n’est qu’étant en constante agitation elles entrent en collisions les unes avec les autres lors de chocs dont la plupart sont élastiques (avec conservation de l’énergie cinétique). La théorie cinétique des gaz permet de calculer qu’à la température de 15°C les molécules de l’air sont animées de vitesses de l’ordre de 500 m par seconde (voir fig. 1, courbe à 300 K) et qu’à cette température et à la pression d’une atmosphère chacune subit plusieurs milliards de collisions par seconde. De plus, ces molécules présentent une large distribution de vitesses qui est fonction de la température en accord avec la loi de Maxwell-Boltzmann (Fig. 1).
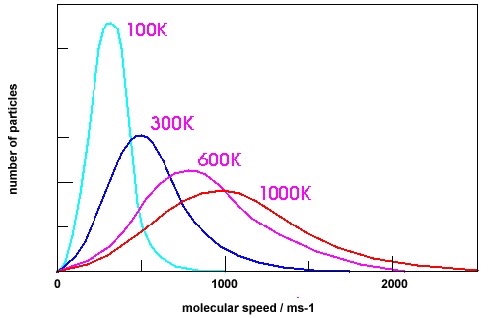
Fig. 1 Loi de distribution des vitesses de Maxwell-Boltzmann
Les molécules de l’air ne sont pas seulement animées de mouvements de translation. Si elles disposent de l’énergie suffisante elles peuvent aussi entrer en vibration avec variation rapide et périodique des longueurs ou des angles de leurs liaisons interatomiques. Contrairement aux mouvements de translation dont l’énergie peut varier d’une manière continue seuls certains niveaux énergétiques de vibration sont permis. La mécanique quantique nous apprend, en effet, que l’énergie de vibration ne peut varier de manière continue. A chaque fréquence de vibration permise est associée une énergie qui peut être déterminée expérimentalement par spectroscopie d’absorption dans le domaine infrarouge ou Raman. Les molécules biatomiques N2 et O2 sont très rigides et ne vibrent pratiquement pas à 15°C. Par contre, les molécules triatomiques de CO2, linéaires à l’état fondamental O=C=O, peuvent se déformer facilement et devenir anguleuses en vibrant. L’énergie de cet état de vibration peut être calculée à partir de la bande d’absorption détectée à 15 µm dans le spectre infrarouge du CO2 grâce à la relation Ev = hc /λ (où h est la constante de Planck, c la vitesse de la lumière et la longueur d’onde du rayonnement absorbé, dans ce cas 15 µm). Cette valeur n’est que de 30 % supérieure à l’énergie cinétique moyenne des molécules environnantes N2 et O2 qui, d’après la théorie cinétique des gaz, vaut Ec = 5/2 k T (où k est la constante de Boltzmann et T la température en Kelvin). Or, beaucoup de molécules ont une vitesse et donc une énergie cinétique supérieure à la moyenne comme l’indique la fig. 1 (la vitesse moyenne est très proche du maximum de la courbe de distribution des vitesses).
En l’absence d’une source extérieure de rayonnement l’énergie nécessaire pour exciter la vibration de CO2 ne peut provenir que de l’énergie d’agitation thermique du milieu ambiant. La quantification de l’énergie n’intervenant pas au niveau des mouvements de translation les énergies cinétiques de translation Ec = mv2/2 présentent une large distribution continue semblable à celle illustrée sur la fig. 1. La fonction mathématique correspondant à ces courbes permet de calculer qu’à 15°C plus de 40 % des molécules N2 et O2 ont suffisamment d’énergie cinétique pour amener les molécules de CO2 à leur plus bas niveau de vibration lors d’une collision inélastique (sans conservation de l’énergie cinétique). Dans ces conditions il y a conversion d’une fraction ∆ de l’énergie cinétique de translation des molécules N2 ou O2 en énergie de vibration du CO2 :
∆Ec (translation) de N2 + CO2 ↔ ∆Ev (vibration) de CO2 + N2 (1)
Ce ne sont évidemment pas toujours les mêmes molécules de CO2 qui sont en état de vibration car cette conversion est réversible et les molécules se désactivent endéans quelques microsecondes pour retourner à l’état fondamental lors de nouveaux chocs avec les molécules environnantes qui, de ce fait, acquièrent temporairement un surcroît d’énergie cinétique de translation.
Il existe donc un équilibre dynamique résultant des très nombreuses collisions. Il ne dépend que de la température et de la pression (par le biais de la distribution des énergies et du nombre de chocs entre molécules). Quoique ce ne soient pas toujours les mêmes molécules de CO2 qui vibrent la proportion de molécules en état de vibration reste constante à une température et une pression déterminées (environ 40 % à 15°C et à la pression d’une atmosphère).
Les molécules de CO2 amenées à l’état de vibration pourraient-elles se désactiver par réémission du rayonnement de 15 µm correspondant à l’excédent d’énergie de ce niveau par rapport à l’état fondamental ? Un tel phénomène de désactivation radiative est bien connu entre niveaux d’énergie électronique et est appelé fluorescence mais il n’a été observé entre niveaux d’énergie de vibration qu’à très haute altitude à des pressions extrêmement faibles (voir paragraphe 2c ici ). La raison en est qu’en solution ou en phase gazeuse à des pressions voisines d’une atmosphère la désactivation radiative ne peut entrer en compétition avec la désactivation par collisions que pour des états excités de très courte durée de vie (10-9 à 10-7 s). Ces derniers peuvent alors émettre un rayonnement avant qu’une collision inélastique se produise. Ce n’est pas le cas des états de vibration dont la durée de vie est de l’ordre des millisecondes. L’équilibre (1) ne sera donc pas modifié si certaines molécules de CO2, en plus des collisions dues à l’agitation thermique, étaient excitées par absorption d’un rayonnement de longueur d’onde appropriée λ (15 µm en l’occurrence) car cet apport d’énergie serait rapidement converti en un surcroît d’énergie de translation des molécules environnantes. Le fait qu’à 15°C et à la pression d’une atmosphère les molécules de CO2 à l’état de vibration ne peuvent se désactiver par réémission d’un rayonnement est une conclusion essentielle pour comprendre l’influence que ce gaz pourrait avoir sur le climat.
« à 15°C plus de 40 % des molécules N2 et O2 ont suffisamment d’énergie cinétique pour amener les molécules de CO2 à leur plus bas niveau de vibration lors d’une collision inélastique ».
Svp, puis-je avoir une analyse un peu détaillé d’où cette valeur de >40 vient ?
Merci pour votre commentaire qui me permet de corriger une valeur qui, dans l’article auquel vous vous référez, résultait d’une approximation dans l’utilisation de l’équation de distribution des vitesses de Maxwell-Boltzmann.
Cette valeur a été corrigée dans une note ultérieure http://www.science-climat-energie.be/2020/12/11/leffet-de-serre-et-le-bilan-energetique-de-la-terre/ et les 40 % ont été réduits à 20 %. J’écris au paragraphe 2.4 de cette nouvelle référence :
L’importance des mouvements de vibration et de rotation des molécules atmosphériques dépend de la température. Toutes ces molécules peuvent subir, à des degrés divers, des mouvements de vibration et de rotation si elles disposent de l’énergie suffisante. En l’absence de rayonnement extérieur, par exemple dans une boîte opaque, cette énergie provient du milieu ambiant sous l’action des nombreuses collisions qui sont un moyen d’échange énergétique. On peut calculer grâce à la relation Ev = hc/λ (où h est la constante de Planck, c la vitesse de la lumière et λ la longueur d’onde du rayonnement absorbé) les énergies requises pour provoquer les transitions de vibration de CO2 à 15 µm et de H20 à 6,3 µm. D’autre part, on peut calculer par la relation Et = mv2/2 quelles devraient être les vitesses des molécules N2 à 15° C pour atteindre ces énergies c’est-à-dire pour que Et = Ev. On trouve respectivement environ 700 m/s pour exciter la vibration de CO2 et 1100 m/s pour exciter la vibration de H2O. L’intégration de la fonction de distribution des vitesses de Maxwell-Boltzmann montre qu’à 15 °C, 20 % des molécules N2 ont une vitesse supérieure à 700 m/s et 1 % une vitesse supérieure à 1100 m/s. En fonction du principe d’équipartition des énergies on en déduit qu’à 15° C statistiquement 20 % des molécules CO2 seraient en état de vibration mais seulement 1 % des molécules H2O.
Merci pour votre réponse éclairante.
Dans l’ensemble, le texte constitue un bon point de départ pour comprendre le rôle de la température et des collisions dans l’excitation des vibrations moléculaires. Mais je pense qu’il est important de rappeler que l’énergie d’activation (Ea) est un concept distinct et qu’elle est toujours supérieure ou égale à l’énergie du rayonnement absorbé (Ev).
Or, le texte suppose peut-être un scénario simplifié dans lequel toute l’énergie gagnée lors de la collision (équivalente à l’énergie cinétique Ec de la molécule de N2) est directement canalisée dans la vibration spécifique. Si l’absorption d’un photon d’énergie Ev = h · c / λ fournit à la molécule une énergie supplémentaire, toute cette énergie n’est pas directement utilisée pour la réaction souhaitée car une partie de l’énergie peut être perdue en raison de collisions ou de réarrangements internes au sein de la molécule. Par conséquent, la molécule doit surmonter une barrière énergétique supplémentaire (soit l’énergie d’activation Ea) avant de pouvoir subir la réaction spécifique.
Dans le texte, il est suggéré de calculer la vitesse des molécules de N2 nécessaires pour avoir une énergie (Et) égale à l’énergie vibratoire (Ev) du CO2 et du H2O. Cela ne se traduit pas directement par l’énergie d’activation de ces vibrations (car Ea>Ev).
S’il semble raisonnable (mais j’aimerais en avoir la confirmation) de supposer une valeur de Ea supérieure de 30 % à celle de Ev, alors qu’il en soit ainsi :
En = 6.62607015 · 10^-34 · 2.998 · 10^8 / (15 · 10^-6) ≈ 1.986 · 10^-25 / (15 · 10^-6) ≈ 1.320 · 10^-20 J
Ea = 1.320 · 10^-20 · 1.3 = 1.716 · 10^-20 J
La masse moléculaire de N2 en kg étant égale à mN2 = 28 · 1.66053904 · 10-27 ≈ 4.64950651 · 10^-26 kg, on trouve la vitesse de vN2 = (2 · 1.716 · 10^-20 / 4.64950651 · 10^-26)-2 ≈ 859.15 m s-1 pour exciter la vibration de CO2.
Cette valeur est supérieure à celle de 700 m s-1, ce qui implique une fraction inférieure à 20% de molécules de N2 ayant une vitesse supérieure à celle nécessaire pour exciter la vibration du CO2.
Je vous serais reconnaissant de bien vouloir confirmer ce raisonnement et les calculs correspondants.
Votre calcul est correct mais votre hypothèse de départ est fausse car il n’y a pas lieu d’envisager une énergie d’activation dans le cas d’un transfert d’énergie entre molécules. Le concept d’énergie d’activation intervient dans des réactions chimiques lorsque la transformation des réactifs en produits implique le passage par un complexe transitoire « activé » dans lequel certaines liaisons entre atomes se rompent alors que d’autres se forment. Cela n’intervient PAS dans le cas d’un transfert d’énergie entre molécules au cours duquel aucune liaison entre atomes n’est modifiée.
Merci d’avoir relevé ma faute. En effet, j’ai pris le raccourci d’appliquer le concept d’énergie d’activation, qui s’applique aux réactions chimiques transformant les réactifs en produits, au transfert d’énergie entre molécules. En réalité, je voulais souligner qu’au cours de ce transfert, plusieurs processus peuvent entraîner des pertes d’énergie, tels que les collisions avec d’autres molécules environnantes, les réarrangements internes dans la molécule réceptrice, ou les conversions en d’autres formes d’énergie. Ainsi, une énergie additionnelle serait nécessaire pour compenser ces pertes d’énergie lors du transfert entre molécules, afin de garantir que la quantité d’énergie requise pour initier la vibration spécifique dans la molécule réceptrice soit adéquate malgré les pertes éventuelles. J’apprécierais une confirmation de la validité de ce raisonnement et, le cas échéant, une estimation de cette fraction d’énergie requise.
Votre idée d’énergie « additionnelle » n’a aucun sens. Dans les basses couches atmosphériques, à des températures voisines de 15° C et à des pressions de l’ordre de 1 atm, les molécules de l’air subissent chacune environ 7.10^9 collisions par seconde (d’après la théorie cinétique des gaz). Lors d’une collision inélastique (sans conservation de l’énergie cinétique totale) avec des molécules N2 (ou O2) suffisamment rapides, certaines molécules de CO2 à l’état fondamental sont excitées à l’état de vibration par un transfert d’énergie T-V (translation-vibration). On estime, sur base de données expérimentales, que seulement 0,001 % des collisions sont de ce type mais 7.10^4 collisions inélastiques par seconde reste un nombre considérable. Si cela peut vous rassurer, la plupart des collisions ne sont donc PAS efficaces sans que cela n’implique l’intervention d’une « énergie d’activation » pour les autres.
En sens inverse, des molécules de CO2 à l’état de vibration peuvent se désactiver par collisions inélastiques lors d’un transfert d’énergie V-T. Globalement il existe un équilibre dynamique entre excitation et désactivation (équation (1) de l’article auquel vous vous référez) tel que la proportion de molécules de CO2 à l’état de vibration soit de 20 %. Cette proportion (résultant de la distribution des vitesses de Maxwell-Boltzmann, voir réponse un de vos précédents commentaires) ne dépend que de la fréquence des collisions et donc de la température et de la pression. Elle ne sera PAS perturbée si, en plus des collisions, certaines molécules de CO2 sont excitées par absorption d’une fraction du rayonnement thermique de la Terre.
Merci d’avoir mis de l’ordre dans mes idées et merci pour le service que vous nous rendez. J’ai hâte de continuer à lire vos articles.
Bonjour Monsieur Geuskens,
Et pourtant, le sol reçoit un rayonnement IR important en provenance de l’atmosphère (Trenberth l’évalue à 342 W/m2, et le SIRTA, à Orsay, le mesure en permanence).
D’où vient alors ce rayonnement si ce n’est des GES de la basse atmosphère ?
Le rayonnement infra-rouge reçu à la surface terrestre provient du Soleil. La valeur de 342 W/m2 correspond au flux énergétique moyen reçu au sommet de l’atmosphère sous forme de rayonnement allant approximativement de 250 à 2500 nm et à peu près pour 50 % dans l’infra-rouge. Dans l’atmosphère, 20 % de ce rayonnement global sont absorbés dans l’infrarouge, principalement par la vapeur d’eau mais aussi par le CO2. De ce fait, ces gaz sont qualifiés sans raison valable de gaz « à effet de serre ». Dans l’atmosphère aucune molécule isolée ayant absorbé une fraction du rayonnement solaire incident ou du rayonnement thermique de la Terre ne se désactive avec émission de fluorescence. L’effet de serre radiatif n’existe donc pas.
Je vous remercie de votre réponse, mais je la conteste :
Tout d’abord, sur les 340 W/m2 que nous envoie le soleil, déduction faite de l’albédo et de l’absorption atmosphérique, il n’en arrive guère au sol plus de 160, et essentiellement en ondes courtes ; je ne vois pas comment ces 160 pourraient se transformer en 342 partant du sol en IR lointain.
De ce fait, je suis d’accord sur le fait que ce rayonnement vers le sol n’est pas un renvoi par l’atmosphère du rayonnement IR émis par le sol, d’autant que sur les 160 reçus par le sol, le sol en renvoie très peu, car l’essentiel est évacué sous forme de chaleur latente.
Par contre, mon sentiment est que les GES atmosphériques rayonnent, comme n’importe quel corps, du fait de leur température : vous contestez cela ?
Je crains que nous ne nous soyons mal compris. Vous écrivez dans votre commentaire datant du 23-07-2024 : « le sol reçoit un rayonnement IR important en provenance de l’atmosphère Trenberth l’évalue à 342 W/m2 ». J’ai cru utile de préciser que « la valeur de 342 W/m2 correspond au flux énergétique moyen reçu au sommet de l’atmosphère sous forme de rayonnement allant approximativement de 250 à 2500 nm et à peu près pour 50 % dans l’infra-rouge ». Comme vous le savez, pour avoir lu et commenté une autre de mes notes publiées sur ce site, j’estime que la surface terrestre ne reçoit que 50 % de l’énergie reçue du Soleil au sommet de l’atmosphère, soit environ 171 W/m2 (fig. 8 de http://www.science-climat-energie.be/2020/12/11/leffet-de-serre-et-le-bilan-energetique-de-la-terre/ ).
Je persiste à croire, en me basant sur la fig.2 de la référence citée ci-dessus, que 50 % au moins du rayonnement reçu par la surface terrestre en provenance directe du Soleil est émis dans le domaine infrarouge entre 750 et 2500 nm. Les 240 W/m2 détectés par satellites à des altitudes de l’ordre de 1100 km proviennent globalement de la surface terrestre et de l’atmosphère mais PAS directement. Je propose au paragraphe 4.3 de la référence citée une explication concernant l’origine du rayonnement détecté par satellites. Je l’ai rappelée dans ma réponse à votre commentaire du 26-05-2024.
Je ne partage pas votre sentiment que « les GES atmosphériques rayonnent, comme n’importe quel corps, du fait de leur température ». Dans ma réponse à ce même commentaire j’ajoute : « Dans les basses couches atmosphériques les molécules individuelles (H2O et CO2 que vous qualifiez de GES), excitées par absorption d’une fraction de l’énergie provenant du Soleil ou de la surface terrestre, ne peuvent PAS émettre de fluorescence à quelque niveau que ce soit, car même à 12 km d’altitude, quand la vapeur d’eau est entièrement condensée (température et pression de l’ordre de – 60 °C et 200 hPa), la fréquence des collisions entre molécules est encore de l’ordre de 10^9/s. Quelle que soit l’altitude, les molécules individuelles (H2O et CO2) se désactivent toujours par collisions avec les molécules environnantes N2 et O2 ».
Rebonjour,
Nous ne parlons pas de la même chose : je vous parle du rayonnement IR « lointain » descendant, entre 7 et 30 microns (et non pas de la queue de rayonnement solaire jusqu’à 2,5 microns), capté par exemple, par les interféromètres IR AERI (voir https://www.ssec.wisc.edu/aeri/), et mesuré par le SIRTA (voir https://sirta.ipsl.polytechnique.fr/sirta/data/quicklooks/).
Je ne vois pas bien d’où peut provenir ce rayonnement, si ce n’est pas de l’atmosphère (ses GES en l’occurrence), comme le montrent les graphes de cette présentation d’AERI.
Je réponds toujours aux questions précises qui me sont posées au sujet des notes que j’ai publiées sur ce site. Comme vous le savez les questions et réponses apparaissent directement en dessous de la note concernée. Cela permet aux lecteurs de prendre connaissance de ces informations et cela évite à l’auteur de reprendre plusieurs fois les mêmes explications. Je regrette de ne pas avoir compris vos derniers commentaires très imprécis qui ne concernent en rien la note déjà ancienne (2018) à laquelle vous vous référez.
Si je comprends mieux maintenant vos derniers commentaires, ils se résument à la question :
A quoi est dû le rayonnement détecté par les AERI ?
Cette question m’a déjà été posée à plusieurs reprises et je résume ci-dessous l’essentiel de mes réponses antérieures.
Les spectromètres de type AERI (Atmospheric Emitted Radiance Interferometer) pointés vers le ciel mesurent un rayonnement dans la gamme de 400 à 3000 cm-1 qui provient essentiellement des nuages et de l’humidité atmosphérique par réflexion, diffusion et/ou émission. Il dépend de leur état physique (gouttelettes liquides, microcristaux ou mélange) et des conditions atmosphériques en général (couverture nuageuse, température, vitesse et direction du vent). Dans les travaux que vous citez de scientifiques étudiant les AERI on ne trouve aucune relation entre les spectres relevés et une éventuelle « back radiation » résultant de la désactivation radiative de molécules ayant absorbé une fraction du rayonnement thermique de la Terre.
Ce n’est que très marginalement que quelques adeptes de la théorie du réchauffement climatique d’origine anthropique ont cru trouver dans le rayonnement enregistré par AERI une preuve expérimentale de l’effet de serre radiatif mais, en fait, c’est de l’absorption par la vapeur d’eau et le CO2 qui se manifeste dans ce cas et PAS de l’émission.
En effet, la vapeur d’eau absorbe fortement entre 1450 et 1800 cm−1 tandis que le CO2 absorbe à 667 et 2250 cm−1 et c’est précisément dans ces régions que les spectres AERI présentent des anomalies. Ceci est dû au fait qu’aucun rayonnement provenant des hautes couches atmosphériques, quelle que soit son origine, ne peut atteindre les AERI au niveau du sol dans ces gammes de nombres d’onde car il serait absorbé sur une dizaine de mètres d’épaisseur atmosphérique par le CO2 et la vapeur d’eau. Les parties de spectre dans ces régions sont donc «récupérées» («retrieved» voir référence ci-dessous) sur base d’un programme informatique reliant « température de brillance » (= température du corps noir qui émettrait la même intensité à la longueur d’onde considérée) et longueur d’onde émise. Ceci apparaît nettement sur la fig.1 de https://arm.gov/publications/tech_reports/arm-tr-066.pdf
En conclusion, si les AERI mesurent bien une « downward long wave radiation » ce n’est PAS une «back radiation » résultant de la fluorescence (désactivation radiative) de la vapeur d’eau ou du CO2.
Re-bonjour Monsieur Geuskens,
Je m’excuse profondément si je vous amène à vous répéter, mais la question me turlupine, car je vous considère comme quelqu’un de sérieux.
Je vous cite :
« Dans les travaux que vous citez de scientifiques étudiant les AERI on ne trouve aucune relation entre les spectres relevés et une éventuelle « back radiation » résultant de la désactivation radiative de molécules ayant absorbé une fraction du rayonnement thermique de la Terre. Ce n’est que très marginalement que quelques adeptes de la théorie du réchauffement climatique d’origine anthropique ont cru trouver dans le rayonnement enregistré par AERI une preuve expérimentale de l’effet de serre radiatif »
J’en suis totalement d’accord, et ce n’est pas ce que je prétends : le sol n’est pas réchauffé par l’atmosphère ; c’est le contraire. Donc écartons ce point.
Vous dites également : « qu’aucun rayonnement provenant des hautes couches atmosphériques, quelle que soit son origine, ne peut atteindre les AERI au niveau du sol dans ces gammes de nombres d’onde car il serait absorbé sur une dizaine de mètres d’épaisseur atmosphérique par le CO2 et la vapeur d’eau.
J’en suis également totalement d’accord : ce rayonnement ne peut pas provenir des hautes couches de l’atmosphère (sauf de l’ozone stratosphérique au travers de la Fenêtre, en atmosphère assez sèche mais c’est négligeable).
Il n’en demeure pas moins que l’atmosphère est chaude, et je prétends personnellement qu’en tant que telle, elle rayonne, comme tous les corps, à sa température, dans les bandes de la vapeur d’eau et du CO2, à la limite basse de leur opacité, (et de l’ozone stratosphérique au travers de la Fenêtre), et que c’est ce rayonnement que mesurent les AERI, et qui correspond aux 342 W/m2 du diagramme de Trenberth, et que MODTRAN montre d’ailleurs bien dans ses simulations. Il provient donc au contraire, selon moi, des basses couches de l’atmosphère (quelques dizaines de mètres d’altitude dans la bande du CO2, un peu plus haut pour la vapeur d’eau).
C’est là qu’est notre désaccord, car, si je vous comprends bien, vous prétendez que ce rayonnement est impossible, et/ou qu’il provient donc d’ailleurs.
Et pourtant, si l’atmosphère était un corps solide dont la surface inférieure se trouvait à quelques dizaines de mètres d’altitude, je pense que vous accepteriez mon rayonnement.
Je ne suis pas un fin connaisseur des mécanismes radiatifs moléculaires, mais quelle différence cela fait-il ?
Merci pour votre dernier commentaire.
Vos commentaires successifs ne m’ont pas ennuyé même si mes réponses peuvent paraître un peu brutales. Au contraire, ils m’obligent à préciser mes explications.
Certains climatologues, et non des moindres, ne distinguent pas clairement les caractéristiques spécifiques d’un rayonnement thermique et d’un rayonnement de fluorescence. C’est pour tenter de dissiper cette confusion que j’ai rédigé le premier paragraphe de ma note http://www.science-climat-energie.be/2020/12/11/leffet-de-serre-et-le-bilan-energetique-de-la-terre/ . J’en résume ci-dessous les points les plus importants.
Concernant le rayonnement de fluorescence.
En phase gazeuse, et en particulier dans l’atmosphère terrestre, des molécules individuelles ne peuvent émettre de la fluorescence que si, et seulement si :
1°elles ont été préalablement excitées, le plus souvent par absorption d’un rayonnement dont l‘énergie permet une transition entre niveaux d’énergie quantifiés. C’est le cas pour CO2 et H2O ayant absorbé un fraction du rayonnement thermique de la Terre mais PAS pour «l’atmosphère chaude … qui en tant que telle rayonne, comme tous les corps, à sa température, dans les bandes de la vapeur d’eau et du CO2» pour reprendre votre expression.
2° l’émission de fluorescence n’est PAS en compétition avec d’autres mécanismes de désactivation plus probables, le plus souvent par collisions avec des molécules environnantes. Pour CO2 et H2O dans les basses couches atmosphériques la désactivation par collisions est 40.000 fois plus probable que par rayonnement. Dans ces conditions, ces molécules ne rayonnent PAS.
La probabilité de désactivation par rayonnement ne dépend PAS de la température pour des molécules individuelles mais lors d’interactions avec les molécules environnantes elle peut dépendre de la température par l’intermédiaire de la fréquence des collisions qui varie en 1/T^(1/2) mais certainement pas en T^4 (confusion avec la formule de Stefan-Boltzmann, voir ci-dessous).
Concernant le rayonnement thermique.
La formule de Stefan-Boltzmann qui est déduite de l’équation de Planck lie l’émittance hémisphérique globale en W/m2 c’est-à-dire le flux par unité de surface émis à toutes les longueurs d’onde et dans toutes les directions à partir d’une surface plane à la température T (en K) à la puissance 4 :
E (T) = σ T^4
En toute rigueur l’émittance hémisphérique ne peut être reliée à la température que si le rayonnement thermique est le seul mécanisme d’échange énergétique. Si les satellites détectent au sommet de l’atmosphère l’émission sous forme de rayonnement de 240 W/m2 on ne peut PAS en déduire, par application de la formule de Stefan-Boltzmann que la surface terrestre devrait être à la température de 255 K (-18°C). De même, le fait que la température « globale moyenne » de la Terre soit 288 K (15°C) ne permet PAS d’en déduire que le flux radiatif émis par la Terre serait de 390 W/m2. A ce propos, le diagramme hypothétique de Trenberth auquel vous faites allusion (reproduit sur la Fig.1 de https://www.science-climat-energie.be/2024/07/26/le-systeme-terre-atmosphere-est-il-a-lequilibre-energetique/) avec 398 W/m2 d’émittance et 342 W/m2 de « back radiation » détectable selon vous par AERI est sans fondement.
Les basses couches atmosphériques ne peuvent PAS jouer le rôle de corps noir car elles n’en présentent aucune des caractéristiques spécifiques. Elles n’ont pas de surface, les transferts énergétiques n’y sont pas exclusivement radiatifs et elles n’absorbent ni émettent toutes les longueurs d’onde puisque les constituants atmosphériques présentent un spectre de raies en absorption comme en émission. Assimiler l’atmosphère à un corps solide, comme vous le suggérez, est une simplification osée !
J’ai pour principe de ne pas critiquer sur ce site les travaux d’autres auteurs, quelle que soit leur opinion, mais j’estime qu’il est contraire aux principes de base de la spectroscopie d’émission rappelés ci-dessus d’utiliser le modèle MODTRAN pour simuler l’émission de rayonnement infrarouge dans l’atmosphère en fonction de la température.
Je vous remercie de votre patience, que je mets à rude épreuve.
Je ne suis pas non plus un accro de MODTRAN, mais j’ai une discussion parallèle avec un collègue qui ne jure que par MODTRAN et HITRAN, d’où mon allusion.
Je n’assimile pas l’atmosphère (et ses GES) à un corps noir, … et tous les corps solides ne peuvent pas non plus y être assimilés (le verre par exemple).
Par contre, j’ai tendance à considérer les GES comme n’importe quel corps, qui absorbe et émet dans les mêmes bandes de fréquence, et à sa température ; dans ces bandes, ils deviennent opaques au delà d’une certaine concentration.
Prenons l’exemple du CO2 dans sa bande à 667 cm-1 (15 microns) :
Le rayonnement terrestre y est complètement bloqué : vu du sol, il apparaît opaque à quelques dizaines de mètres (comme un brouillard) : on ne voit pas au delà ; de même, vu du sol, on ne perçoit aucun rayonnement qui vienne de plus haut ; mais on perçoit tout le rayonnement qui vient de plus bas, c-à-d émis de moins de ces quelques dizaines de mètres … à la température du sol, ou quasiment.
Je perçois ces quelques dizaines de mètres, comme une surface d’émission, épaisse si on la compare à celle d’un solide, mais avec le même comportement.
De même, vu cosmos (OLR), on ne perçoit, dans cette bande, aucun rayonnement qui vienne de plus bas que la stratosphère (sauf sur les bords).
C’est tout-à fait ce que montre le graphe OLR de la fig 9 votre article https://www.science-climat-energie.be/2020/12/11/leffet-de-serre-et-le-bilan-energetique-de-la-terre/
Pour résumer, je vois cette bande du CO2 comme un corps solide qui aurait la même bande d’absorption, dont la surface du bas serait à quelques dizaines de mètres d’altitude, et celle du haut dans la stratosphère, ces deux « surfaces » rayonnant à leur température (dans cette bande).
Idem pour la vapeur d’eau.
Sinon, autre question : de ce que je comprends, la fluorescence est une forme de rayonnement ; est-ce que ce rayonnement est émis dans les mêmes bandes d’absorption ?
Vos récents commentaires et mes réponses successives concernant le bilan énergétique du système Terre-atmosphère témoignent de points de vue très différents. Je crois inutile de rappeler mon interprétation déjà évoquée dans mes réponses antérieures et dans la référence que vous citez mais si vous avez encore des questions précises je reste disposé à y répondre aussi souvent que nécessaire pour me faire bien comprendre.
Cordialement